解读生命的设计—为何它微如尘埃亦巨至大象?
来源: 时间:July 2, 2014, 10:31 a.m.http://blog.sciencenet.cn/blog-1475614-808322.html
解读生命的设计—为何它微如尘埃亦巨至大象?
生命个体的设计原理是生物群落(或植被)等高层次生命系统构建的基础。
一、生命的大小尺度特征—极度的多样化
在这里我们先来略览一下若干生命层次(生物界、类群、生物大分子)的大小尺度的多样化程度。
1. 生物界物种大小的多样化
对地球这一庞大的生命系统中物种的分门别类是生物学发展早期的重要任务,现在也依然如此。一般根据亲缘与进化关系等将生物分为各种不同的门类,如Sahn等于1949年提出将生物划分为五界:原核生物界、原生生物界、真菌界、植物界和动物界。Woese于1977年提出三域系统—细菌域(Bacteria)、古菌域(Archaea)和真核域(Eukarya)。根据生态功能,自然界的生物可以简单地分为生产者、消费者和分解者三大类。
生产者能够通过光合作用把太阳能转化为化学能,把无机物转化为有机物,不仅供其自身的生长发育,也为其他生物提供物质和能量。在水体中的生产者主要是浮游藻类,以及一些生长在浅水中的有根植物或漂浮植物,而陆地生态系统中的生产者主要为草本植物、灌木和乔木。生产者的大小跨度极大,小的浮游藻类直径仅有1-2 μm,而澳洲的杏仁桉最高可达156 m。
消费者指捕食生产者或其他消费者的动物,一般将以植物为食的动物称为初级消费者,而将捕食其它动物者称为次级消费者。动物大小差异极大,一些以浮游藻类为食的小型浮游动物(无脊椎动物)体长不到1 mm,而在高等动物—脊椎动物中,最小的是一种生活在新几内亚的青蛙,其体长只有0.77厘米(Rittmeyeret al. 2012),而最大的脊椎动物—蓝鲸体长可超过30m(Calambokidisand Steiger 1998),重量可超过190 t(SmithsonianNational Zoological Park, 2011)(图1)。
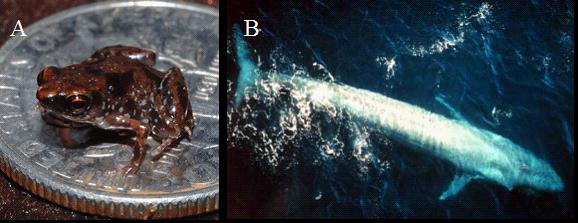
图1 世界上最小和最大的脊椎动物:(A)一只生活在新几内亚的青蛙(Rittmeyeret al. 2012)和(B)一条出现在东太平洋海域的成年蓝鲸(引自Wikipedia)
生态系统中的分解者主要是异养菌类,还有一些原生动物和小型无脊椎动物等,它们将死亡有机体所含的物质转换为无机成分。与生产者和消费者不同的是,这些分解者都是一些微型生物。与大型动植物相比,这些微型生物单位体积的表面积要大得多,因此,保持着最快速的分解代谢速率,这也许是生态系统中主要的分解活动都是由一些微生物来行使的重要原因。
图2像一把尺子,丈量着各个生命层次的大小,很明显,从分子、细胞到由无数细胞构成的动植物的大小差异极大,较大的动植物肉眼可见,较小的微生物需要光学显微镜才能看见,而一些细胞器及生物大分子等需要电镜才能观察。
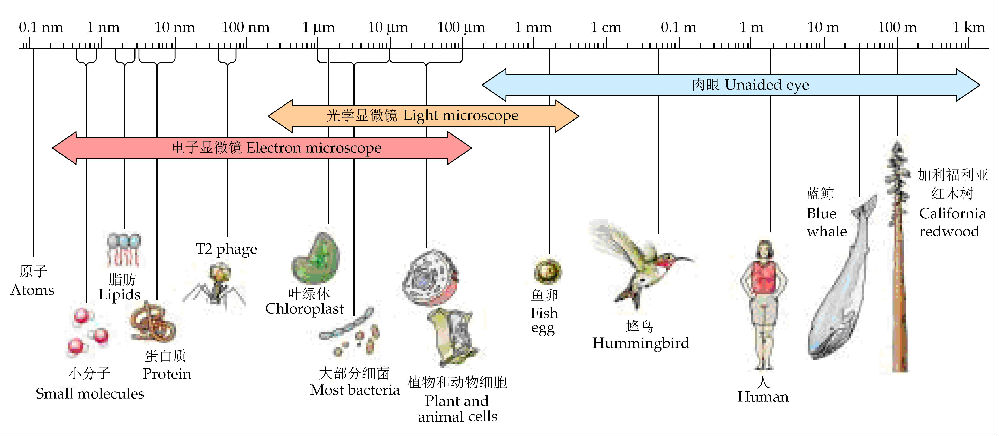
图2 生命的尺度,显示分子、细胞和多细胞有机体的相对大小(引自Purves et al. 2003)
2. 群内生物大小的多样化
不仅生物类群之间体积有很大分化,一些类群的不同种属之间也出现巨大的体积分化,恐龙就是一个很好的例证。恐龙是一种陆栖爬行动物,出现于约2.3亿年前的三叠纪,灭绝于约6500万年前的白垩纪晚期,曾统治全球陆地生态系统长达1.6亿年之久!恐龙家族极为庞大而多样,已确定的恐龙有500多属、1000多种。
图3显示了形形色色、大大小小的各种恐龙。恐龙的体积多样性非常极端,最大的恐龙—易碎双腔龙(Amphicoelias fragillimus)长达40–60 m,重达122.4 t,约为蓝鲸体长的两倍,体重的三分之二(Carpenter 2006),而最轻的一种恐龙—赫氏近鸟龙(Anchiornis huxleyi)只有110 g(Xu et al. 2009),最短的恐龙(如小驰龙Parvicursor remotus)体长只有30 cm(Holtz 2012),因此,最重的恐龙和最轻的恐龙的体重相差1.1 x 105倍!易碎双腔龙生存于白垩纪中期至侏罗纪晚期,分布于美国科罗拉多州,以植物为食;而小驰龙生存于白垩纪晚期,分布于蒙古,肉食性。因此,小的恐龙不一定就是最古老的,而大的恐龙也不一定就是年轻的,形形色色的恐龙或许源于生态位细化或由于恐龙向不同生境扩散导致的隔离与分化,或者两者机制的联合作用。

图3 白垩纪的食草动物—恐龙,显示其相对体积,(1)腕龙,(2)巨龙,(3)剑龙,(4)甲龙,(5)结节龙,(6)角龙,(7)原角龙,(8)禽龙,(9)鸭嘴龙,(10)树龙,(11)奇异龙,(12)鹦鹉嘴龙,(13)肿头龙(仿Poinar & Poinar 2008)
3. 生物大分子大小的多样化
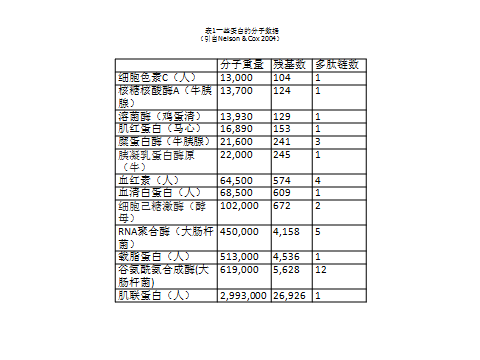
不光是动植物个体呈现体积(或体长或重量)上的巨大变异性,生物体内的大分子也是如此。蛋白质是生命的结构物质,是构建形形色色生命的物质基础,也具有许多重要的生物学功能。表1是一些蛋白质的分子大小,同样是人体内的蛋白,细胞色素C分子量仅为肌联蛋白的1/230。蛋白质大小和结构的分化主要是因为这些蛋白需要承担各式各样的生理功能,是结构与功能长期适应的结果。譬如,细胞色素C是一种细胞色素氧化酶,为生物氧化过程中的电子传递体,位于线粒体内侧外膜;而肌联蛋白是已知的自然界中最大的弹性蛋白(长度达1μm),伸展时比原长度多出3μm,在肌肉收缩和舒张时保持肌球蛋白纤维位于肌节的中心,肌联蛋白为许多蛋白提供结合位点,在肌节形成过程中充当生物尺的作用。
二、进化的趋势—通过多样化和复杂化不断扩展生命尺度
地球上的生命呈现出一种永不停息的进化趋势,即它们绝不放过任何微小的变异(这里不管是何种机制)机会,只要能带来改进或革新,能适应未被完全占用的生境或能获得竞争能力去侵占已被其它物种占用着的生境,它就会延续和发展下去,形成新的变型,甚至分化出新的物种。进化也是一个颇具争议的词汇,人们往往意指进步,在这里的进化广义地指演化。
1. 进化的趋势—体型多样化和复杂化
1)生命进化的主流—包括复杂化的多样化
地球上如此纷繁的生命世界到底是从什么开始进化的?古生物学证据已经证实,35亿年前地球上的生命只有细菌,也就是说,生命是从图4左侧最小的复杂性开始,趋向于向右边越来越复杂的生命进化,同时一些生物的体积也趋向逐渐增大(虽然这并不是绝对的)。地球生命的演化历史告诉我们,多样化和复杂化(经常还伴随着大型化)是生命进化的主流,但一些进步论者常常将这种复杂化称之为“进步”,并将其普遍化,因此而遭受到攻击。
需要指出的是,生命系统的复杂化趋势,并不意味简单生命的消失,事实上,简单的生命(如古老的细菌)仍然无处不在,也占据着属于它们的那一份生态位,也仍然未停止继续分化。说白了,有些功能(如生物残体的分解)并不适合复杂的生命去干,细菌仍然握有绝活,不可替代。因此,从某种意义上来说,应该说是进化伴随着生命的多样化(包括复杂化)的发展,添加了许多复杂化(一些人喜欢叫进步)的类群。也许还有一些生命保持了变化不大的状态(但绝对没有一点变化也是不可能的),有些甚至出现“退化”(结构简化)。因此,进化的结果绝非只有普遍“进步”,但同时也不能完全否认“进步”的存在。从本质上来看,由于生命演化中普遍存在的复杂化现象,自然选择推动的物种分化注定是一种不可逆过程。
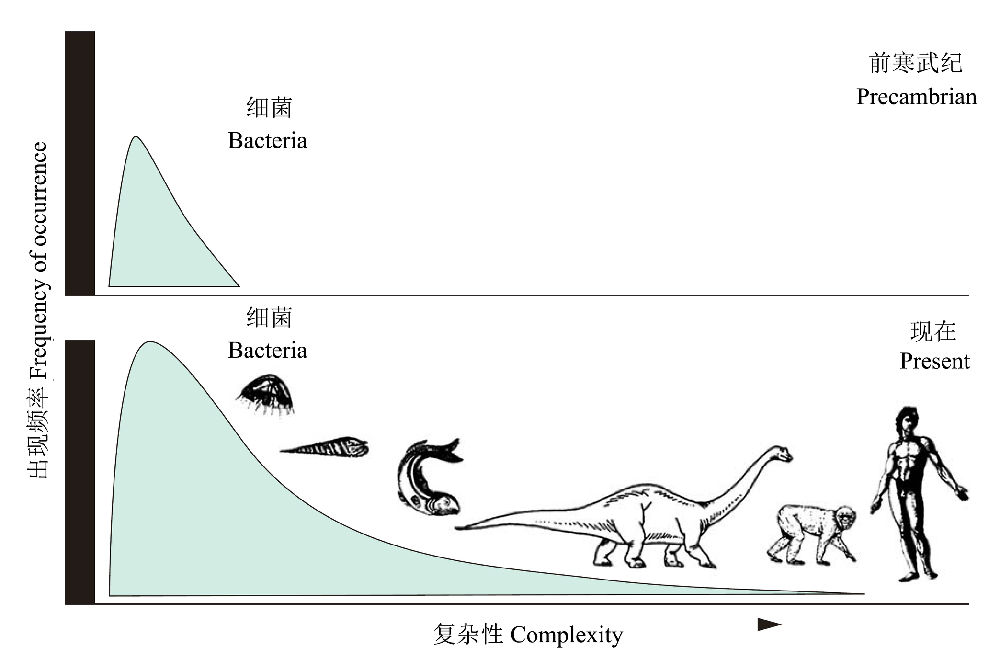
图4 复杂性的进化。生命从左侧最小的复杂性开始(上图),进化发展的唯一方向就是变得越来越复杂(下图),由StephenJay Gould提供(仿Lieberman& Kaesler 2010)
2)简化—也是生命演化的方向之一
另一个不可否认的事实是,在生命演化过程中也出现了大量的结构简化的例子。复杂性实质性减少普遍出现于寄生虫的生活模式,涉及到成千上万的种类,它们寄生于宿主体内吸食宿主血液或宿主已消化的食物,已不再需要消化或运动器官,但为了特殊需要,可能会有一两种新的器官出现—抓住宿主的钩、吸食食物的吸管等,但它们几乎变成了生殖系统构成的袋子或管子—简单的生殖机器,一种依附在宿主的内部器官罢了。这样,这些寄生虫损失的器官比增加的多得多,所以结构大大地简化了(古尔德2009)。第十一章中要介绍的从天南星科的大型祖先植物演化出最小的被子植物—漂浮在水上的芜萍是另一个结构简化的很好例子。
因此,简单化也是进化的方向之一是毋庸置疑的,这一方面从基因的随机突变(如基因的缺失)的概率上来讲是可能的,另一方面一些复杂的生命由于生存环境的变迁(如气候干旱化,从自由生活转为寄生,等等)也能向简单化的方向发展,如上所说的寄生虫的结构一般都会比其祖先简单。
事实上,生命演化的过程不仅仅是进化(通常是结构复杂化),也包括退化(通常是结构简化),还有一些类群变化不大的类群。因此,生命演化的结果不一定都是“进步”,也有“退步”。实际上所谓“进步”也是相对的,离不开生存条件。在一定条件下的复杂“进步”当巨大的环境灾变降临时,也会遭遇灭顶之灾(如恐龙)。因此,我倾向于给进步加上引号。
一些物种趋于简单化的理由似乎容易理解,但是为何绝大多数生命要向复杂的方向进化?为何简单原始的生命(细菌)还能一如既往在属于它们的“领地”中生存至今?生命复杂化是进化的原因(进化生物学中的进步论学派)还是结果?这些问题在后续的章节中都会有所涉及。
2. 进化的趋势—遗传信息复杂化
生物的复杂性也可从遗传信息的复杂性来表征,也即在大的趋势上,可以粗略地用基因组的大小来衡量。所谓基因组是指包含在某种生物的DNA(部分病毒是RNA)中的全部遗传信息。从图5可以看出,随着生物的进化,基因组有逐渐增大的趋势,即病毒<细菌<真菌<植物、动物。譬如噬菌体MS2的基因组只有3569bp,大肠杆菌增加到4,600,000 bp,酵母增加到12,100,000bp,而人的基因组增加到3,200,000,000 bp(3.2Gb);当然,基因组大小与进化程度的关系也不是绝对的,如一种单细胞原生动物—无恒变形虫(Polychaos dubium)的基因组达到670,000,000,000bp(670Gb),是已知最大的基因组(Wikipedia)。
即便如此,从趋势上来看,随着生命的进化,生物复杂性不断增加,储存遗传信息的基因组也不断增大,也驱动生物体积的逐渐增大。
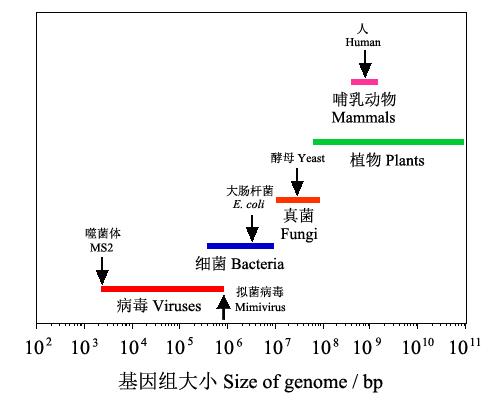
图5 各种生物的基因组大小比较(仿MicrobiologyBytes2007)
3. 进化的趋势—体积趋于增大
早在一个多世纪以前,美国古生物学家柯普(Cope1896)就观察到化石记录中常常出现体积增长的趋势,被称之为柯普定律(Cope’s law)。譬如,马是从和狗一般大小的动物持续进化,愈变愈大的,同时脚趾持续萎缩,终于变成蹄;象的始祖本来只有猪那么大,历经数千万年的进化,后代终于变成庞然巨物,同时象牙逐渐伸长,愈形复杂(齐默2011)。
从猴→猿→人的进化历程是一个体积逐渐增大的过程(图6),如人与猴子相比,体长和体重增加了数倍。譬如,体型最小的猴子—侏儒狨猴(Pygmy marmoset)长0.14-0.16m(连尾巴)和重0.12-0.14 kg,虽然最大的猴子山魈体长达0.61~0.81m,体重达54 kg。
图6 从猴→猿→人演化过程中体积的变化趋势(由MartinLeFevre博士提供)
在过去的5500万年,北美的马科动物体积的变化也说明了这种进化趋势的存在(图7):在最初的3500万年(始新世到中新世早期)期间,以体型相对较小的种类为特征,而在剩下的2000万年(中新世中期至现在),马的体积发生了明显的分化,出现一些体型较大的种类(MacFadden2005)。最早的始祖马仅约0.6 m长,身体只有狐狸那么大,而现代马的有些品种体重可达1200 kg,体高可达2 m!
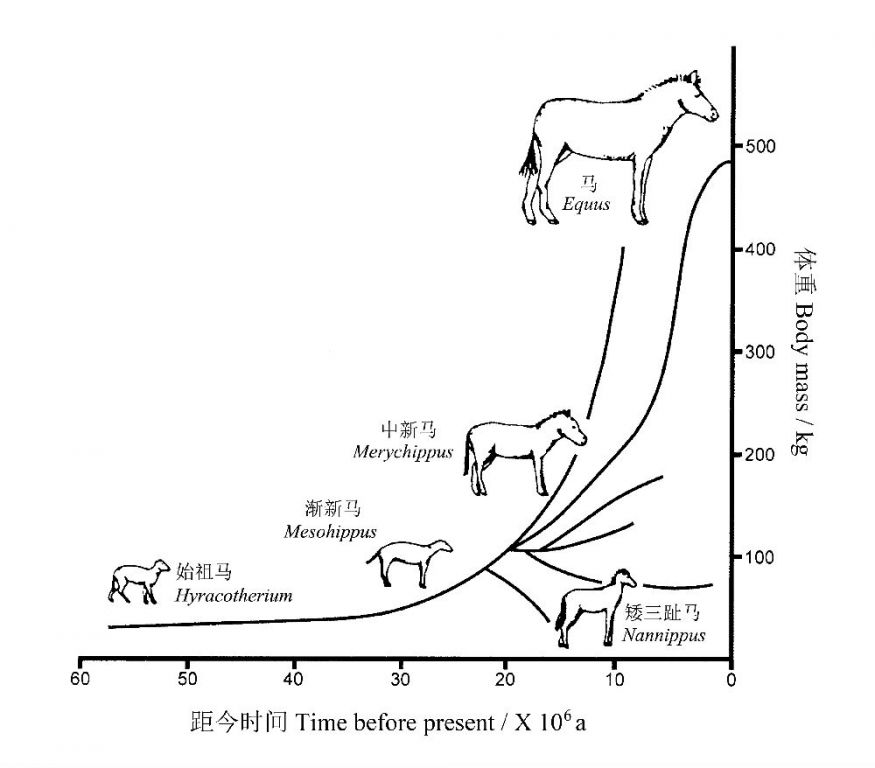
图7 北美化石马体积进化格局,基于MacFadden(1987)(仿Gould& MacFadden 2004)
菊石(ammonite)体积的变化是进化过程中体积多样化的一个很好的例子。菊石是一种水生无脊椎动物(隶属于软体动物门头足纲),最早出现在古生代泥盆纪初期(距今约4亿年),繁盛于中生代(距今约2.25亿年),于白垩纪末期(距今约6500万年)灭绝。在侏罗纪早—中期,菊石很少会超越直径575px的大小,到了侏罗纪晚期—白垩纪早期,就开始出现了一些较大的形体,如英格兰南部的泰坦菊石直径达1325px,而在白垩纪的一种德国菊石(Parapuzosia seppenradensis)其直径更是达到2m。图8是距今2—1.5亿年期间不同大小菊石物种数的分布格局的变化,大约在5000万年期间,菊石的种类以及体积不断多样化,表现在:物种数、物种的平均直径以及最大直径均稳步上升(Stanley1973)。尽管菊石体积如此的多样化,最终它们还是没有逃脱灭绝的命运。

图8 进化时期菊石体积频数分布的扩展(Peters1983修改自Stanley 1973)
柯普现象虽然普遍存在,但是也会出现许多例外,有些类群可能体积变化不大,有些甚至可能会变小。此外,变大的趋势也不是无限增加,大的物种也不一定具有永恒的优势,也是局限于一定的地质历史时期以及一定的气候与生态环境背景,像巨大的恐龙的灭绝就是一个范例。无论如何,在过去的地质历史时期,许多类群向体型变大的方向进化或者体型多样化是不争的事实。
4. 脊椎动物的进化趋势—脑趋向于增大
由神经细胞构成的脑是动物行为、体内稳态、学习记忆的控制中心,也是动物复杂性的象征。在脊椎动物的进化过程中,其身体和脑的体积均呈现增加的趋势,不仅体重与脑重呈正相关关系,而且进化程度越高,单位体重脑的重量也趋于增大。譬如,鸟类从原始的爬行动物进化而来,从图9a不难看出,鸟类的多边型完全在爬行动物之上,表明同样的体重,鸟类的脑比爬行类更重。总体来看,单位体重的脑重哺乳动物最大,而人位于离回归线最远的上方,即在哺乳动物中人的脑容量又是最大的(图9b),而小型哺乳动物与鸟类大量重叠(Shettleworth 2010)。
人类脑容量的显著增加是人类意识智能化的重要物质基础。在600万年前,我们祖先的大脑大约只有我们现在的1/3大小,有理由相信,他们的心智水平与其它猿相似,可能通过咕哝和手势进行交流,不会用火或制造复杂的石制工具,也还无法深刻理解其他同伴的想法或感受,虽然这只是一种可能永远都无法得到证实的猜测(齐默2011)。
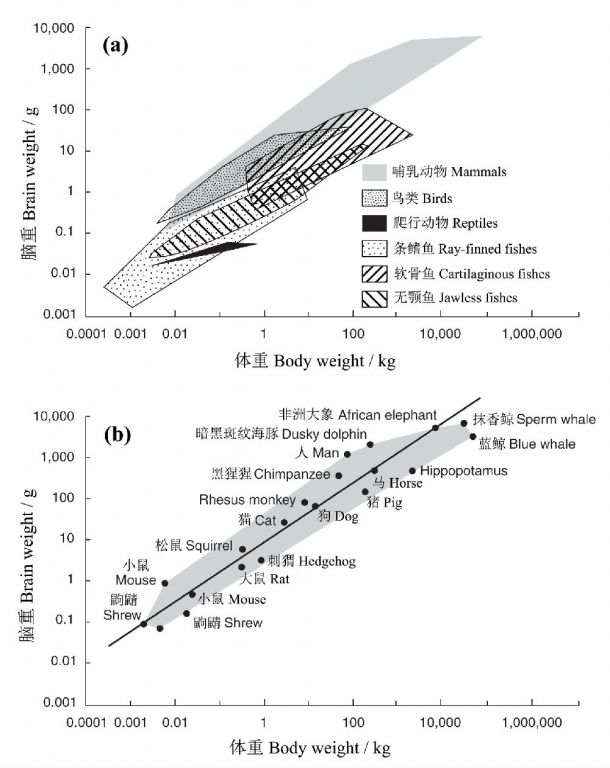
图9 脊椎动物脑重和体重的关系(对数尺度):(a)主要类群的数据作为包含每个类群数据的最小多边形而表示,(b)被最小多边形包围的一些哺乳动物的数据。黑色的斜线为哺乳动物的回归线,某一物种离该线的垂直距离(正式的说即残差)是该种偏离平均异速关系程度的度量(Shettleworth 2010重绘自Striedter 2005以及Roth andDicke 2005)
三、气候对动植物体格的塑造
生命是地球环境演化的产物,生物的生存离不开一定的环境,特别是气候条件。在诸多的气候要素中,温度和水分是动植物生存的基础,影响着个体的生长发育。地域性动植物群落的外貌或特征往往与气候有着密切的关系,这将在后续章节中介绍。这里只讨论温度对动物体积、降雨对树木高度的影响。
早在19世纪,德国生物学家卡尔﹒伯格曼(Christian Bergmann)发现:同一物种在越冷的地方个体体积越大,外形越接近球形,因为在同等温度下,体积越大,散热越慢,而相同体积中的球形的表面积最小,也最利于保暖,这被称之为伯格曼定律(Bergmann's rule)。换言之,较大体积的动物对低温的耐受性也较强,因为大动物在寒冷条件下散失热量比小动物慢。当然,动物还演化出一些其它的方式抵御低温,如毛皮、脂肪层等。
在低温对动物的体重影响方面,对哺乳动物的影响尤为受到关注。大量的研究表明,温度,特别是极端低温,对动物的生存及分布范围起到至关重要的作用。从图10可以看出,年最低温度显著影响北美和南美地区哺乳动物的体重,即二者呈明显的负相关关系,遵循伯格曼定律。
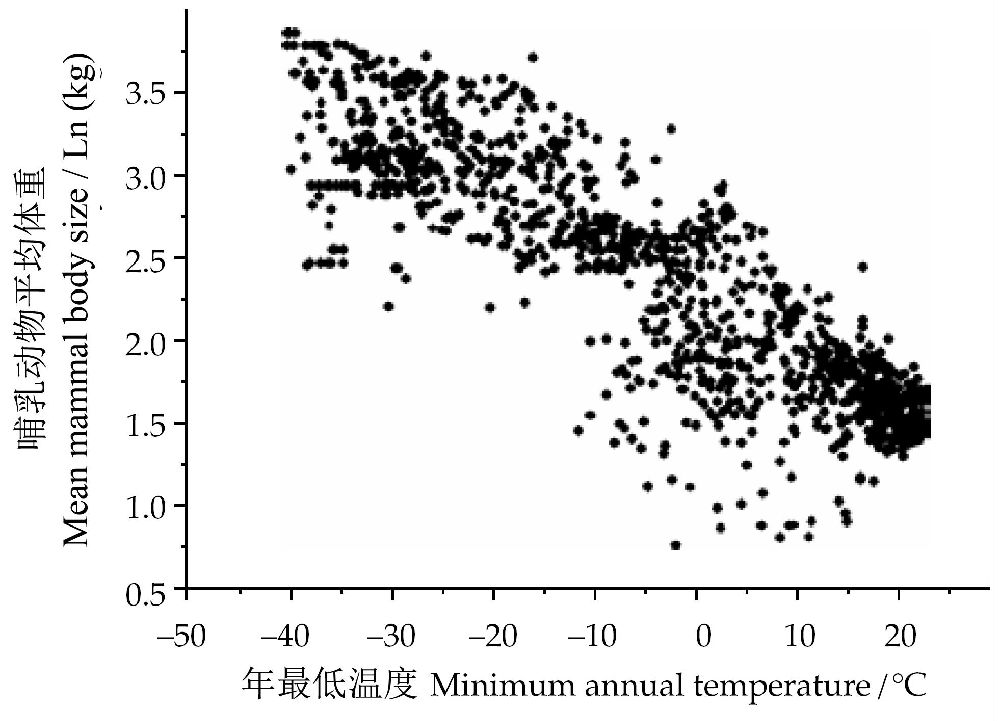
图10 北美和南美地区哺乳动物(1755个物种)体重与最小周年温度之间的关系(引自May and McLean 2007)
Rodríguez等(2008)研究了新北区和新热带区不会飞翔的陆生哺乳动物平均体重与年平均温度的关系,一共收集了土居于西半球的1328种陆生哺乳动物的体重资料。哺乳动物平均体重在新北区向北增加,与温度负相关,而在新热带区则在热带—亚热带的低地最大,在安第斯山脉较小,与温度正相关(图11)。也就是说,在较寒冷的气候区,伯格曼规律明显,而在较温暖的气候区,体重的变化可能更受制于其它因素的影响(因为此时对低温的适应越来越没有必要了),譬如,一种可能的解释是,也许是山区有限的生境限制了大型哺乳动物的生存。
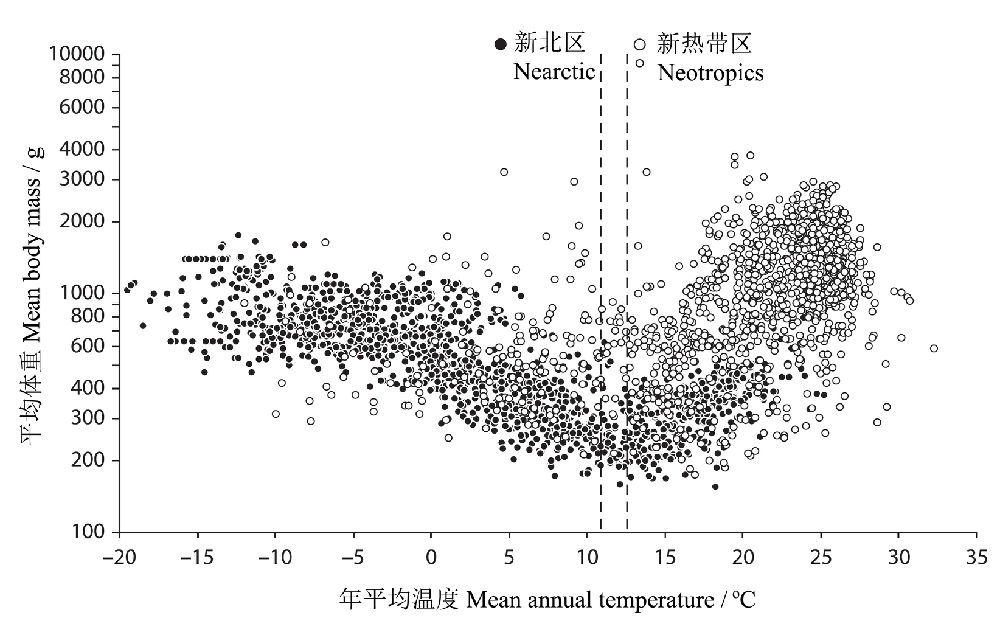
图11 在新北区和新热带区年平均温度与哺乳动物平均体重的关系。虚线是通过分段线性回归确定的每个区域标志关系转折的临界温度(新北区10.9 °C,新热带区12.6°C)(仿Rodríguez et al. 2008)
但是,很多动物通过季节性的迁徙以减少极端温度的影响,即严冬往南,酷暑往北迁移,特别是很多鸟类具有长距离迁徙的习性。像在北极那样的极端低温不仅考验动物的低温耐受性,而且对很多(特别是食草性)动物来说,不得不面临严重的食物匮乏。
2. 气候对植物体格的影响—极端低温和干旱限制树木生长
树线(tree line)就是森林生长的界限,是森林垂直地带格局的重要生态界限,主要由低温、干旱、强风等气候条件所决定。譬如,一般认为如果月平均气温低于7oC,森林将难以生长。树线可以有不同的类型,譬如,沿山地的一定海拔高度出现树线,树线以上为高山灌丛和草甸。树线高度在不同的纬度带会有所变化,一般来说,纬度越高树线越低。树线也与植物群落的类型有一定关系。
水分是植物生长发育的关键要素之一。Williams等(1996)发现,在属于热带气候的澳大利亚北部,沿着降雨量梯度,树冠高度以及林木覆盖率呈现明显的变化,即降雨量和树冠上部平均高度和树覆盖率之间存在显著的正相关关系(图12)。这表明了在相似的高温条件下,降雨量对植被类型的强烈塑造。

图12 在属于热带气候的澳大利亚北部,降雨量和(a)树冠上部平均高度和(b)树覆盖率之间的关系(Eamus et al.2006重绘自Williams et al. 1996)
四、群落复杂化促进生物体积分化
应该只有在地球上生命诞生的初期,才可能有孤独的物种存在。随着物种的日益增多,不同物种间开始出现相互作用。现在世界上的任何生物都不可能孤立的存在,都是生存于由多种生物构成的生物群落以及由这些生物群落与环境相互作用形成的复杂的生态系统之中。有些生态系统相对简单(如贫瘠的沙漠),而有些则几乎具有无限的复杂性(如热带雨林)。
前已述及,生命进化的必然结果是生物的多样化和复杂化,而这是在生物群落(也可以说生态系统)的复杂化过程中实现的。生态系统发育过程中生物群落(特别是动物群落)呈现二个发展趋势:一是捕食与被捕食关系的进化与发展,二是物种间生态功能的分工与细化。这可能是促进生物体积分化的重要生态学机制。
1. 捕食与被捕食关系的进化促进动物体积分化
动物是生态系统中的消费者,它们依赖于能利用太阳能进行光合作用的绿色植物,大多数动物直接取食植物,但也进化出一些捕食动物的动物,还有一些捕食这些捕食动物的动物……,等等,这种捕食与被捕食关系的进化与发展,可能既是物种多样化的基础,也是动物体积分化的重要驱动因子。
图13显示了能量沿捕食—被捕食链的流动金字塔,在此例中,营养级间的能量转换分别为20、15和10%(Ricklefs 1990)。一般来说,食物链越长(即包含的营养级越多),物种分化的程度就可能越大。此外,从图13也可以直观地看出一种趋势,即植物的生产力越高,所能支撑的营养级也越多,物种多样性也就越大,这可以草原和热带雨林二种生态系统的差异来说明,毫无疑问,热带雨林具有最高的生产力、最长的营养级以及最丰富的物种。

图13 一个描绘生态系统的各营养级净生产的“生态金字塔”,类似的,“多样性金字塔”可能也存在,营养级越低,分类多样性越大(仿Allmon & Bottjer 2001)
凭直觉可以想象得到,一般来说,大的捕食者捕食大猎物,小的捕食者捕食小猎物。Peters(1983)收集了103种陆生脊椎动物的体重资料,将捕食者分为二类,一类为哺乳动物和猛禽,吃相对较大的猎物(large-prey eaters),另一类为蜥蜴、两栖动物、海鸟和食虫鸟,吃相对较小的猎物(small-prey eaters),从图14可以看出1)猎物越大,其捕食者越大;2)捕食大猎物的捕食者与其猎物的质量之比要大于捕食小猎物的捕食者与其猎物的质量之比。

图14 捕食者体重和猎物平均体重的关系,捕食者分为大猎物捕食者(哺乳动物和猛禽)和小猎物捕食者(蜥蜴、两栖动物、海鸟和食虫鸟)(仿Peters 1983)
可用捕食者—猎物质量之比来说明这种体积分化。Brose等(2006)利用了来自5个大陆的陆地、淡水和海洋中的捕食者猎物质量比率的数据,获得的log10捕食者—猎物身体质量比的频度分布如图15所示。从中值来看,在3887个无脊椎动物摄食关系的经验数据中,捕食者比猎物重14倍(101.15),而对1501个变温脊椎动物,捕食者比猎物重398倍(102.6)。在比较相似体积的无脊椎动物和变温脊椎动物捕食者时也得到类似的结果,表明所报道的趋势不仅仅反应了变温脊椎动物较大的体重。
这意味着越高等的动物,捕捉猎物需要更大的身体质量,这可能与动物的行为越来越复杂,对捕食者行为调控的要求越来越高。换言之,营养级越高,由捕食驱动的物种体积的分化可能越大。从另一种角度来看,动物越大,所需要的领地越大,所需要的活动范围也越大,运动与迁移能力也越强。
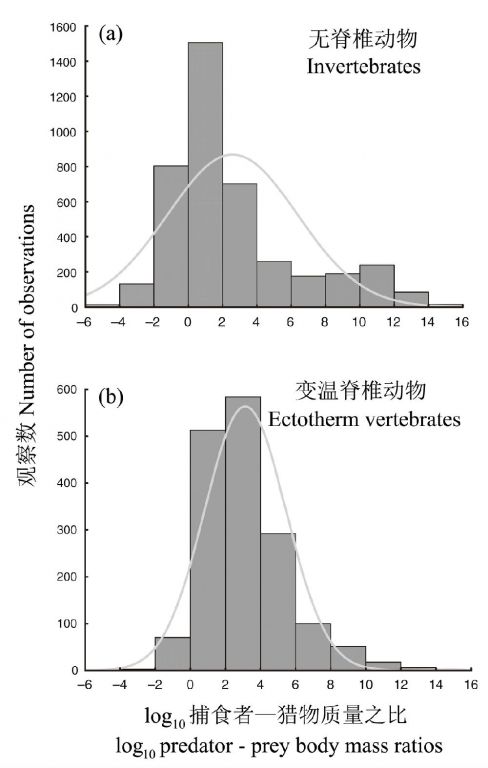
图15 经验的log10捕食者—猎物身体质量比的频度分布:(a)无脊椎动物(n=3887)和变温脊椎动物(n=1501),曲线表示最拟合的对数正态分布(引自Brose et al. 2006)
除了捕食者—猎物系统可促进大型化外,在配偶体系中雄性之间争斗的性选择方式也能促进雄性向大型、凶猛的方向演化。如生活在太平洋沿岸的北象海豹为“一夫多妻”制,只有少数(不足10%)雄性能够交配,这由雄性之间的血腥格斗来决定,硕大的身体猛烈相撞,牙齿在对方脖子上留下深深的伤口,最终优胜者获得交配权,一头雄性头领的配偶数量甚至会高达100头,因此,大型强壮的雄性就能把它们的基因传给下一代,而雌性不需要如此争斗,因此体型没必要长得那么高大,这就是为何雄性重可达近3吨,而雌性只重约700kg(科因2009)。
2. 物种生态功能细化促进有机体体积分化
在各种生态系统中,随着群落中物种的日益增多(群落复杂化),物种间的相互作用(特别是竞争)必然会导致物种生态功能(或生态位)的细化和特化,这反过来又会促进有机体体积的分化甚至物种的分化,新的竞争又会导致新的分化,如此不停地循环往复,其结果就导致群落日趋复杂!
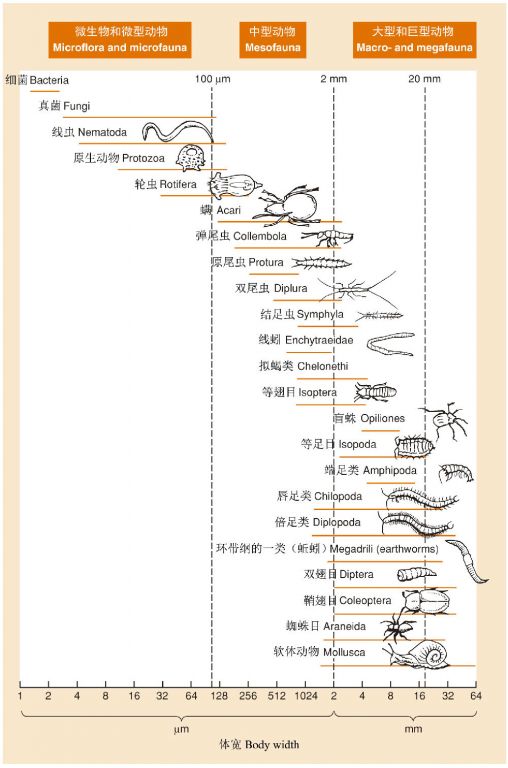
图16 以有机体的身体宽度来划分类型的陆生分解者食物网。以下类群是完全肉食性的:盲蛛(捕猎蜘蛛)、唇足类(蜈蚣)和蜘蛛目(蜘蛛)(Begon et al. 2006仿Swift et al. 1979)
以土壤生态系统为例,很多原生生物和无脊椎动物参与死亡植物和动物的分解,这些生物在分类上极为多样,个体大小分化很大,小的种类仅有1-2 μm,大的超过60 mm(图16)。一般可将土壤生物分为微生物、微型动物、中型动物和大型—巨型动物等,这决不是一种人为随意的划分,不同类型或大小的动物具有不同的行为,譬如不同的掘穴或在凋落物或土壤裂缝中的爬行能力等,不同的行为和生理特性也决定了资源利用方式的不同以及在分解食物链中所扮演的角色的不同。
不同的土壤生物行使着不同的生态功能,其中土壤生物的体积大小强烈地影响营养联系与“生态工程”这两个关键生态过程,当然两者之间又存在互相补充(逐渐变尖的三角型)的关系。以微生物—微型动物为主导的营养联系是能量流动的主要驱动者(这与它们具有快速的代谢速率相吻合),而以中—大型动物为主导的“生态工程”在长时间尺度上对土壤生境的形成至关重要(图17)。
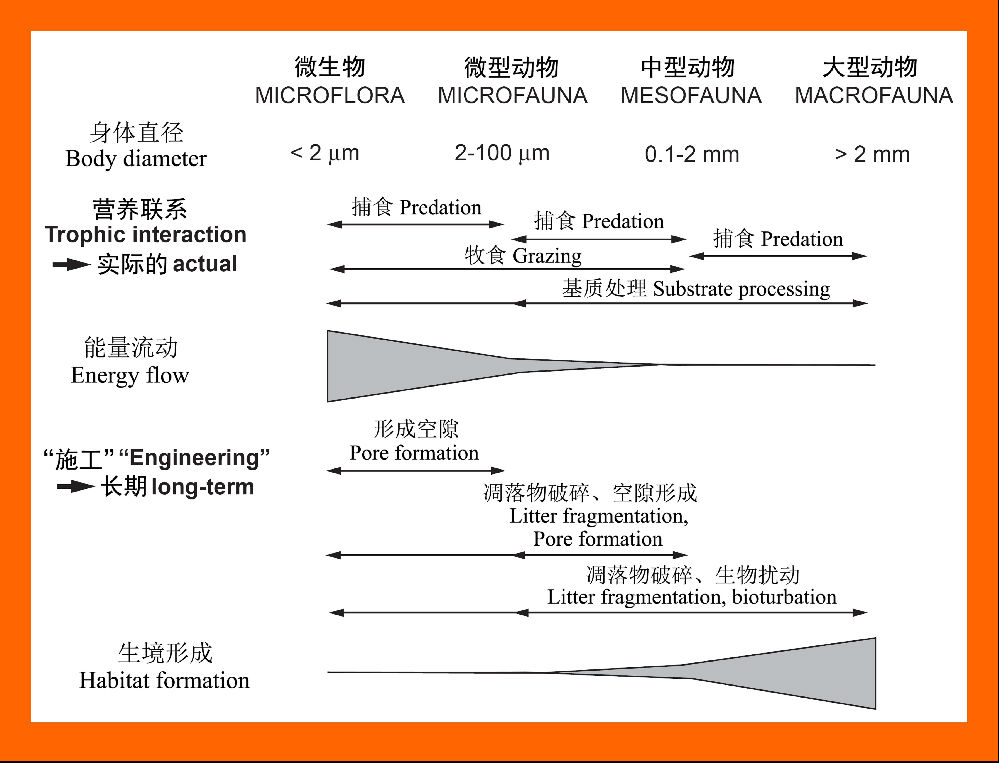
图17 不同大小土壤动物类群间的相互作用,其中营养联系与“生态工程”引起的相互作用被区分开来,两者都用箭头表示(仿Coleman et al. 2004)
五、从生命的尺度看物种生物学特征的设计
生命的多样化和复杂化是生物群落/生态系统演化以及气候环境影响的产物,也是生态功能细化的结果,而生态功能的完成离不开具有相适应的生物物种,因此,个体的生物学和生态学特征应该巧妙地印记在生命的尺度上。
生态系统中存在形形色色的物种,但所有物种的一个共有个体生物学特性是具有有限的生命周期,即寿命。寿命简单地说就是个体生与死之间的时间间隔,由于不同个体的寿命可能不尽相同,因此,一般用平均寿命(也可以称为期待寿命)。很显然,不同生物物种的寿命差异极大,从几分钟到数千年(表2)。
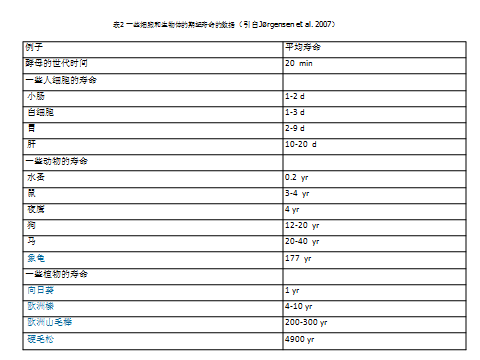
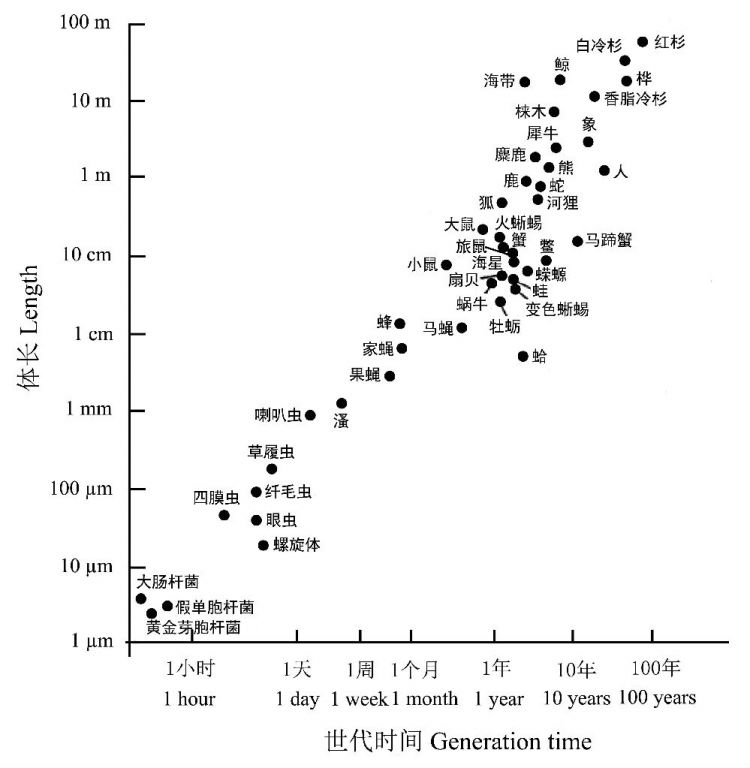
图18 物种(从细菌到红杉、鲸鱼)的体长对世代时间的影响(引自Bonner 1965)
那么,是什么决定一个物种的寿命长短?似乎自然界在设计生命个体大小的时候,分配了不同的寿命,即赋予大个体物种长寿的特性。从日常的经历容易理解,生物的个体越大,世代的时间越长。
图18很好地诠释了这种关系的存在。该图涵盖的物种的体长从数微米到近百米,世代时间从几分钟到几十年。用科恩(2000)的形象说法,“采用多细胞生命形式最重要的代价是延长了繁殖的时间。1年,对狗来说就像人的7年。如果用大肠杆菌作相同的比较,那将会是人的100万年。1年中,某些细菌经历的代数比起人类在地球上的代数还多”。可以看出,从细菌到鲸鱼和红杉,生物有机体大小与时代时间之间存在明显的正相关关系,如果将二者取对数时,有近乎直线的相关关系(Bonner1965)。
为何有机体的寿命和大小之间存在这种很好的正相关性?一种观点认为这可能是由于寿命与单位体重的总代谢成反比,以及由于生物体越小,代谢活动水平越高这一事实所决定的(May 1976)。笔者认为可将细胞构建生物体比着用一砖一瓦构建房子,建一个高楼大厦肯定比建一个小屋需要花费更长的时间吧,这或许是一种最简单的解释。如果生命分配给构建、维持和衰亡的比例大致类似的话,就可能出现这种理想的相关关系,从另一种角度来说,进化总不能愚蠢到好不容易建成“一座高楼大厦”后顷刻间就任其轰然倒塌吧!神秘的物种寿命和衰老或许就是遵循着这样一种相当简单的生态设计原理。
当然,有机体大小和世代时间之间的关系并不是绝对的,也难免会有一些例外。譬如乌龟体型虽不大,但却是最长寿的动物:在澳大利亚动物园一头乌龟活了176年才死,体重约150kg。一只重250 kg的雄性阿尔达不拉巨龟,已经在印度加尔各答的动物保护区里活了200多年。
相对生长率指单位时间单位(动物个体或植株)体重的重量增加,是比较不同类群生长速率的重要指标。Henderson(2006)利用鱼类数据库资料,分析了热带鱼类von Bertalanffy生长模型中的2个重要参数—相对生长速率(K)和极限体长(l∞)之间的关系,发现,二者呈显著的负相关(图19),即与大型鱼类相比,小型鱼类趋近极限体长的速度要快得多,反过来也可以说,极限体长越小的鱼类,相对生长速率越快。这就意味着,自然界在设计生命个体大小的时候,分配了不同的生长速率,即赋予小个体物种快速生长的特性。
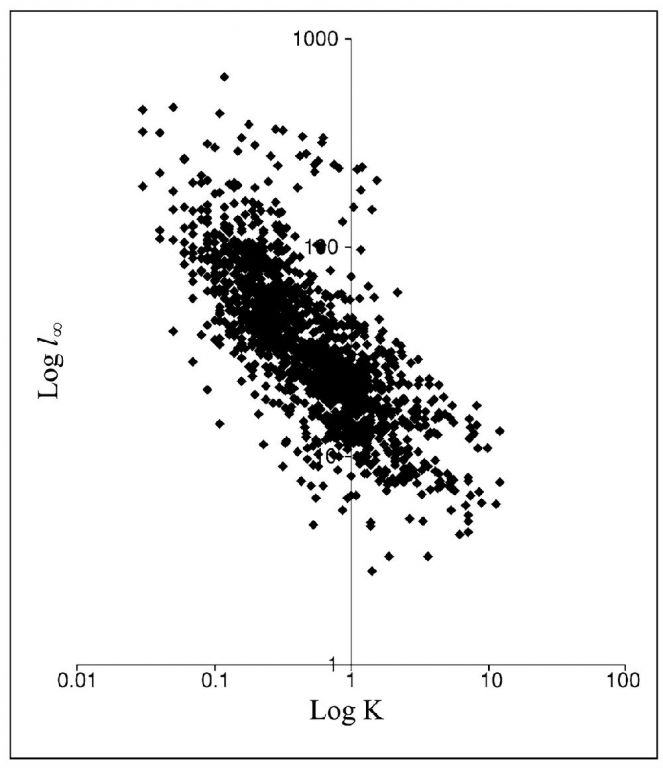
图19 鱼类数据库中热带鱼类的生长常数K和l∞之间的关系(引自Henderson 2006)
3. 体重与摄食率
作为常识,不难理解体重越大的动物需要更多的食物支撑。Peters(1983)根据Farlow(1976)的数据,在对数尺度上,绘制了恒温动物体重(W)和摄食率(I)的关系曲线(图20),得到方程式:I =10.7 W0.70,表明随着体重的增加,摄食量也显著增加,即大型动物需要消耗更多的食物资源。有意思的是,以能值为单位的摄食率在不同营养级动物(牧食者和肉食者)之间几乎没有差别。
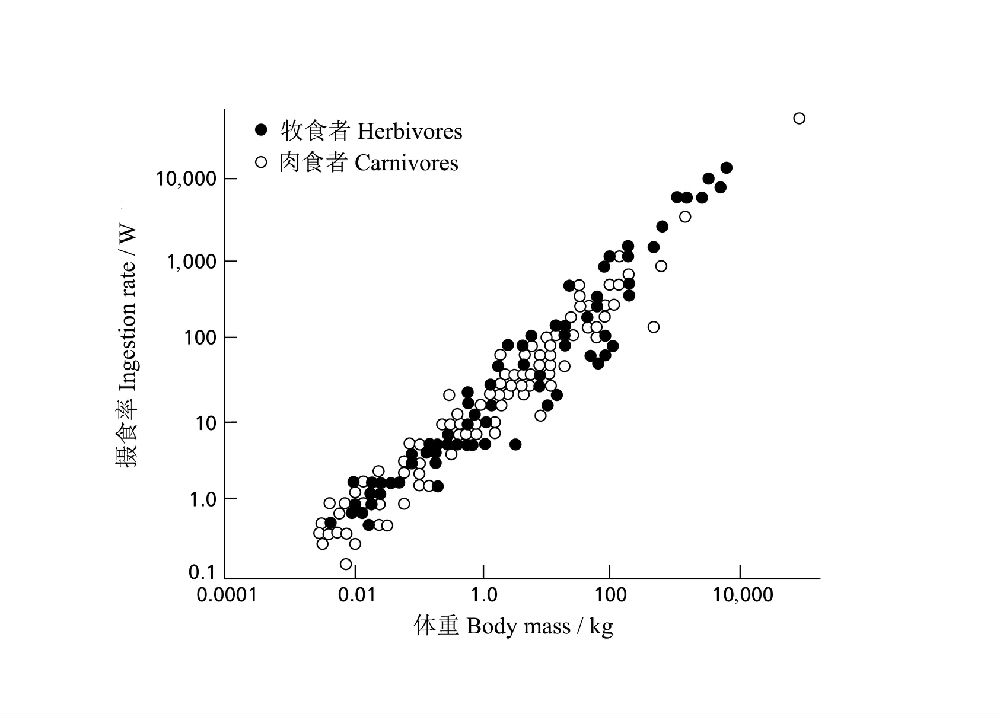
图20 牧食性和肉食性恒温动物摄食率与体重之间的函数关系(仿Peters 1983)
所谓代谢(Metabolism)是指生物体维持生命的所有化学反应的总称,通过这些反应使有机体能够进行生长、发育与繁殖并对环境作出反应。代谢通常被分为分解代谢和合成代谢二类。代谢是生物体不断进行物质和能量的交换过程,代谢的终止即表示生命的终结。而代谢速率(metabolicrate)是指机体内通过有氧和无氧代谢活动,将化学能转化为热和机械功的速率,代谢速率通常以生化反应中热量释出的速率来表示。因此,代谢速率是物种最重要的生理指标之一。
单位重量的代谢速率与生物物种的个体体重之间存在怎样的关系?在对数尺度上,二者之间呈现很好的负的直线相关关系(图21),即身体质量越轻,单位体重的代谢速率越快。这与体重(长)与相对生长速率之间的关系相一致。即生物的质量越小,单位质量的生长速率与代谢速率也越快。
将生物分为三个类群:单细胞生物(噬菌体、细菌、原生动物)、变温动物和恒温动物,则伴随着每一次重要的进化步骤,对于一定大小的物种其代谢速率都有明显的增加,这表明维持同样的体重,恒温动物必须消耗的能量远高于变温动物,而变温的多细胞动物则远高于较原始的单细胞动物(图21)。这就是说,复杂的生命进化付出了代价—需要更多的能量来维持同样质量的生命活动。同时也可以看出,微生物以最小的质量获得了最大的单位体重的代谢速率,这也是一个非常重要的结论。
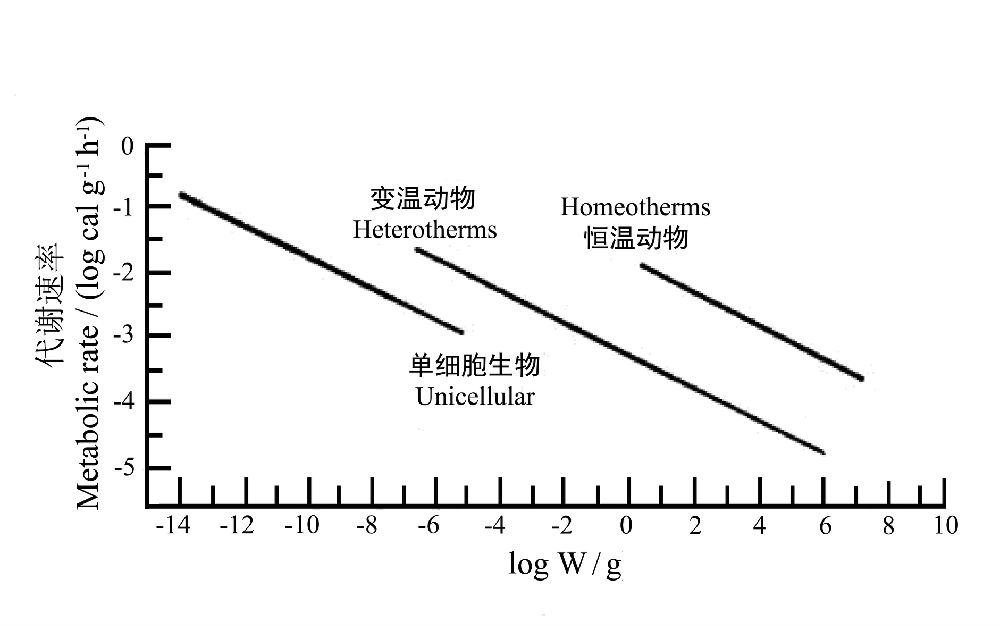
图21 动物体重与单位体重代谢速率之间的关系,数据源自Hemmingsen(1960)(引自Fenchel 1974)
六、从生命的尺度看物种生态学特征的设计
任何一种生物必须在一定的自然环境中生存与发展(这种状态即所谓的生态),那么自然界是如何设计各个物种基本的生态特征的?这些生态特性主要是内禀增长率、种群密度、运动速度、活动范围和物种多样性等,当然这其中的一些特性是动物特有的。
1. 体重与内禀增长率
所谓内禀增长率是指在最理想的条件(缺乏一切制约个体生存的因素—食物、空间、天敌等)下,种群的最大增长速率,它反映了物种内在(或固有)的生理学繁殖潜力。
内禀增长率与生物个体的体重之间存在怎样的关系?在对数尺度上,二者之间呈现很好的负相关关系,即身体质量越轻,内禀增长率越快,譬如单细胞生物的r远高于恒温动物。需要指出的是,伴随着每一次重要的进化步骤,对于一定质量大小的物种其内禀增长率r值都有所增加(图22),但如果与图21比较可以直观地感觉到,每一次重要的进化伴随的内禀增长率的增加程度远不及代谢速率的增加程度。

图22 42个物种内禀增长率(r)和体重(W)之间的关系(引自Fenchel 1974)
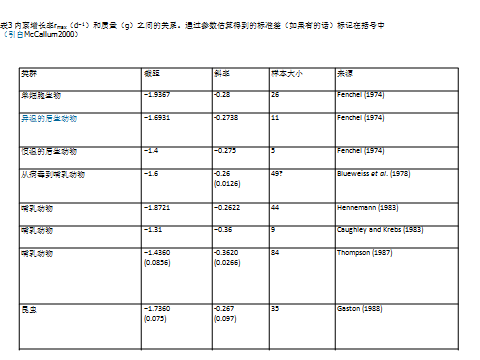
各类生物的内禀增长率(对数)与体重(对数)之间线性回归关系的截距和斜率如表3所示。在多数情况下斜率接近-1/4的理论值,仅有2个例外,可能由于样本偏少或计算公式选择导致偏差(McCallum 2000)。此外,即便根据数据量最大的Thompson(1987)的结果,任一给定质量的rmax值的变异都能达到一个数量级(McCallum 2000)。
因此,自然界在设计生命个体大小的时候,分配了不同的内禀增长率,即赋予小个体物种快速繁殖的特性。
所谓种群密度一般指某一物种在单位面积(或空间)栖息的个体数量。一定面积中能够栖息的物种的最大种群密度与身体的重量呈现很好的负相关关系,在对数尺度上,二者呈近乎直线的相关关系(图23)。道理很简单,较大的动物需要更多的食物和空间用于栖息、繁殖与生长。如一个狮群的领地面积从20到400平方千米不等,因此它们的种群数量注定会十分稀少,而一些小型无脊椎动物如一些昆虫幼虫的活动范围可能局限于产卵地点几个厘米范围之内,但密度可能会高得惊人。

图23 物种(从病毒到红杉、鲸鱼)的密度与身体质量之间的关系(数据源自
Brown等(2004)综合了Ernest等(2003)和Damuth(1987)关于世界各地的资料,在对数尺度上图示了体重和种群密度之间的关系(因哺乳动物的体温非常相似,故未对数据进行温度矫正)。两者呈现很好的负相关关系,回归直线的斜率为-0.77(图24),表示异速指数(allometricexponent)接近-1/4的预测值。
从图24不难看出,同样的体重,位于不同营养级的哺乳动物其种群密度也呈现出一定的趋势性差异:牧食者>杂食者>肉食者,其实这与它们对应的资源量是相吻合的,即由于能量在营养级间大量损失,高营养级生物的可利用资源量显著减少,所能支撑的种群数量也就显著降低。

图24 陆生哺乳动物密度(no. km-2)的对数值与平均体重(g)的对数值之间的关系(仿Brown et al. 2004)
3. 体重与运动速度
运动能力对很多动物的生存具有至关重要的作用,不论对捕食者还是猎物,都可能成为决定它们生存命运的关键因素之一,运动能力的协同进化也是捕食者与猎物系统进化与发展的核心内容之一。
Bonner(1965)在每个运动类型及体重范围中选择了一些较快的动物,如图25所示,最大运动速度随体重的增加而增加;另外,对同样的质量,跑步比游泳快,而飞行最快;此外,与游泳或跑步相比,最大飞行速度对质量变化的响应相对不太敏感。
因此,自然界在设计动物个体大小的时候,分配了不同的运动速度,即赋予大个体物种快速运动的特性,特别是赋予了飞行动物最快的运动速度。
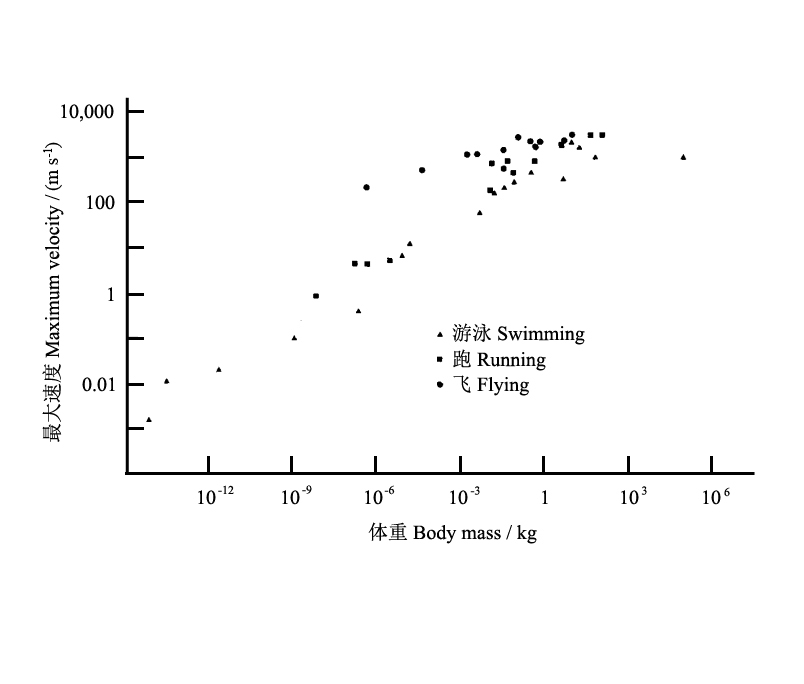
图25 体重对飞行、游泳和跑步最大速度的影响(Peters 1983修改自Bonner1965)
需要指出的是,体重与运动速度的关系也不是绝对的,动物还有其它的方式来进行防御。譬如,大象是最大的陆生动物,但大象的行动却比较迟缓,连跑都不会,一般每小时行进6 km,虽然有时也可达到每小时40km(大陆桥2009)。而一只成年猎豹能在几秒之内达到每小时110 km的奔跑速度!象是素食者,虽然没有快速奔跑能力,但其巨大的身体覆盖有厚达2.5 cm的皮肤,长鼻和长牙是其有效的防御武器,因此大象很少受到捕食者的猎杀。
4. 体重与活动范围
活动范围是动物生活习性的重要特性之一,在一些高等动物(如狮子)甚至分化出个别和少数群体独自占领的生活区域,即领地。
Peters(1983)综合鸟类(Schoener1968)、蜥蜴(Turner et al. 1969)和哺乳动物(Harestad & Bunnell 1979)的资料,得到如图26所示的动物体重和活动范围(home range)之间的关系,不难看出,1)虽然不同的动物类群之间存在一定差异,但动物的活动范围随体重的增加而增加;2)同样的体重,肉食性动物的活动范围比牧食性动物更大;3)恒温动物的活动范围比蜥蜴(冷血爬行动物)要大。
因此,自然界在设计动物个体大小的时候,分配了不同的活动范围,即赋予大个体物种更为广泛的活动范围。
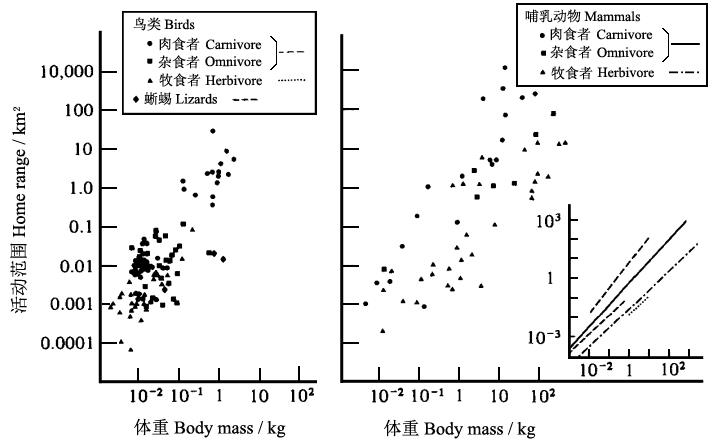
图26 鸟类、蜥蜴和哺乳动物的体重和活动范围之间的关系。插图为拟合数据的回归直线(仿Peters 1983)
5. 体积与物种多样性
物种多样性的成因一直是生命科学的核心问题之一,但却是一个十分复杂又难以准确回答的问题。它是地球上漫长的生命历史演化的产物,关乎到几乎生命科学的所有领域。在影响物种数多寡的各种因素中,生物个体的大小可能是其中之一。
有学者分析了陆生动物体积大小和物种数的关系(图27),发现在大多数情况下,物种数与体积成负相关,即动物越小,物种数越多;但是,当动物体长小于25px时,这种关系曲线明显下折,一种可能原因是分类学家容易忽视这些小型的类群(May 1978,1988)。当然这种解释似乎有些道理,但是也难以完全令人信服。譬如,微生物还是很受人重视的,但是,已报道的古生菌仅175种,细菌也只有10,000种(Groombridge and Jenkins 2002),当然目前绝大多数微生物都还无法进行纯培养,这也是微生物定种面临的一大困难。另一种可能的解释是,生命如果过分简单的话,形态特征的鉴定和区分变得越来越困难,似乎难以区分出更多的物种;或者当生命的结构简化到极限的程度时,无法允许更多的物种存在。
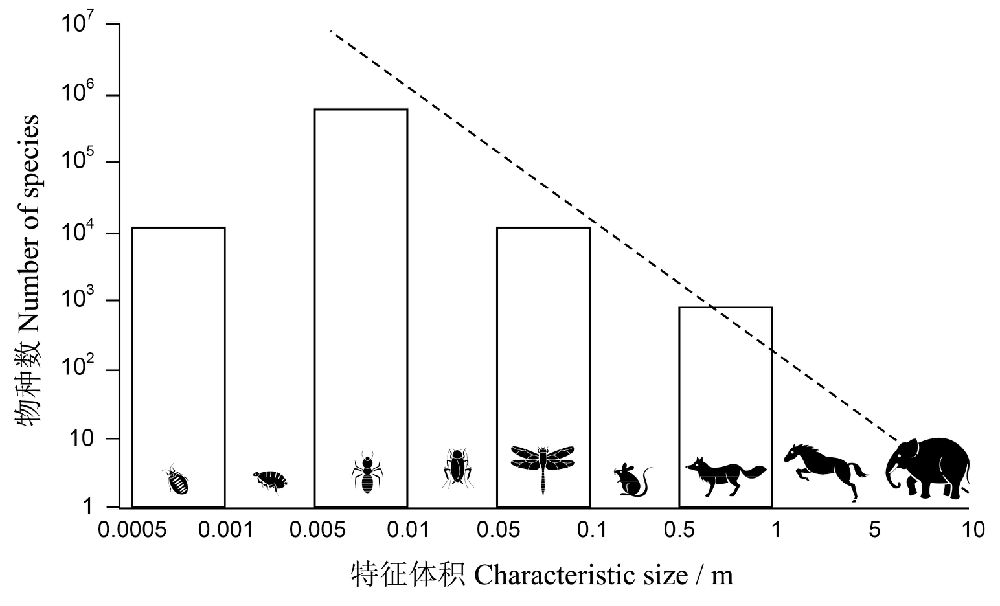
图27 以特征长度(L)来分类的所有陆生动物物种数(S)分布的粗略估算。虚线表示S~L-2的关系,小体积物种的数据相对不足(仿May 1988, Stork 1997)
在高等动物(脊椎动物),体长与物种数的负相关关系十分明显。Southwood等(2006)根据Haskell等(2002)的数据,给出了陆生脊椎动物体长(对数值)和物种数(对数值)的定量关系:y = -1.61x + 7.80,回归线的斜率为-1.61,~-3/2(图28)。这样,可得到如下关系:
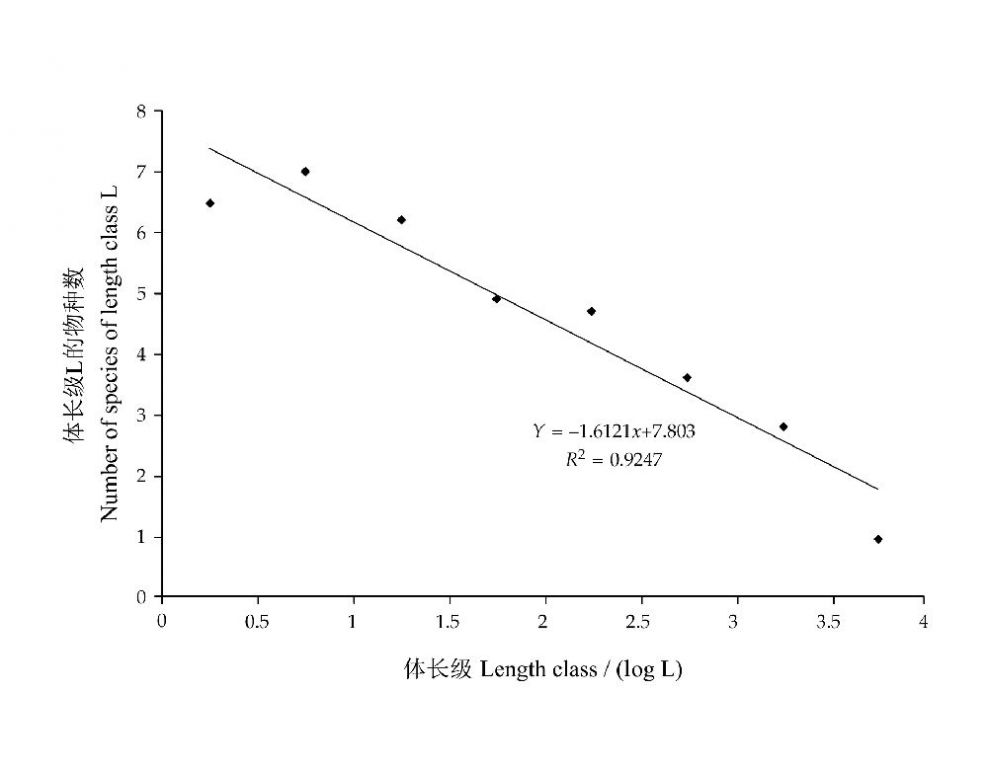
图2-28 陆生脊椎动物长度组L的物种数(对数值)与体长L(对数值)的关系(引自May and McLean 2007)
为何小型脊椎动物比大型脊椎动物要多得多?Hutchison和MacArthur(1959)曾经试图解释这一问题,他们假设,在体积范围的上端,物种的活动范围面积H将与物种的体长L成比例,L2~H,在体长组L的物种的数目S将与H成反比,即S(L)~1/H(L),因此,S(L)~L-2。
大的活动范围,需要运动与迁移能力的增加,而运动与迁移可促进动物体积增大,从这种意义上来说,向运动与迁移能力强化方向的演化,可能是动物体积分化(特别是部分动物大型化)的机制之一。
那么,为什么动物要大型化?猎物—与捕食者的协同演化可能是这种大型化驱动的根本机制。大的猎物(增加逃跑与防御能力)催生大的捕食者(增加运动和攻击能力),更大的捕食者又催生更大的猎物,如此不断演化。
但是,随着动物(不论是猎物还是捕食者)个体的不断增大,消耗的食物越来越多,所需要的领地也越来越大,一定面积的环境所能支撑的物种数以及种群数量也越来越少。显然,捕食者的体积不可能无限增大,事实也是如此,因为庞然大物的劣势会逐渐显现,体积过大必定会带来运动速度的下降。哺乳动物的群体行为(如狼的群体捕食)的演化是以较小的体格成功捕获较大猎物的一种有效的生存策略。
七、从生命的尺度看物种生态对策的设计
所谓生态对策就是生物在种群水平上对环境变化的适应策略,这里的环境既可以是生物的,也可以是非生物的。而种群对环境的适应能力与其增长模型中的一些特征性参数有关。而这种特性折射于自然对生命尺度的塑造之中。
1. r和K对策—“广种薄收”与“精耕细作”
你可以根据直觉感知生物的大小,繁殖的快慢,但依据描述种群行为的逻辑斯蒂模型并从进化的视角来分析物种对环境的生存对策,这是理论生态学家的杰作。从逻辑斯蒂方程不难看出,种群的增长由二个重要的参数所决定—内禀增长率r和环境容量K。直观地看,r与世代时间直接相关,而世代时间与生物的质量或体长又密切相关。
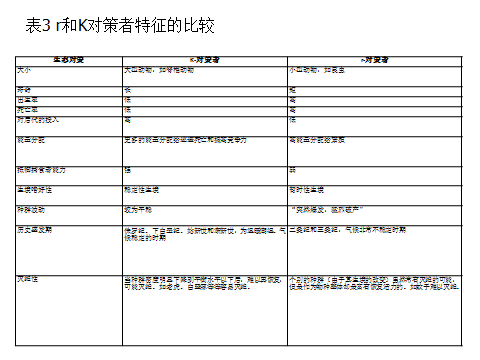
小型物种的内禀增长率高,它们的策略是尽快地生长,尽快地交配(有些甚至主要进行孤雌生殖),尽量多地繁殖,但付出的代价就是自然寿命缩短,亲代难以悉心照顾后代,子代死亡率上升。而大型物种的内禀增长率虽低,但由于个体较大,在种间竞争中常具有优越性,如通过特化的行为和附肢加强进攻或防御,并与长寿结合起来提高对幼仔的照料和保护水平等。r和K对策者特征的比较见表3。
很显然,这是两种完全不同的生存策略,前者(大的r值)被称为r—对策者(r-strategists),后者(小的r值)称为K—对策者(r-strategists),这一概念由MacArthurand Wilson(1967)引入到生态学。
其实,物种的大小、繁殖的快慢、代谢的强弱都不是物种得以生存的唯一因素,事实上形形色色、大大小小的生物物种(无论是进行光合作用的植物界还是依附于此的动物界)在漫长的地球历史长河中都或长或短地在世上共存着。从本质上来说,种群的行为(通俗地说种群变动规律)应该是与其生存环境协同进化的结果。
当然,针对这种生殖对策的划分,也还是有很多例外。譬如海洋中的翻车鱼重达1.9吨,但一条雌鱼一次可产约0.25-3亿枚卵,它因笨拙而常常被其它鱼类或海兽猎杀,却还能生存至今,与其强大的生殖力不无关系。绝大多数鱼类将卵产在水中,进行体外受精,一般情况下,亲鱼无法对卵进行保护,极易被敌害吞噬,死亡率高,因此,一般产卵量都会很高。而进行卵胎生或胎生的鱼类,怀卵量就要少得多,一般只有数枚到数十枚。
2. r和K对策—非稳定性适应和稳定性适应
任何种群都是在与环境的相互作用中生存的,一般来说,在一定的范围内,环境(生物的或非生物的)扰动会使种群偏离平衡,经过若干时间后种群再恢复到平衡。这样,定义一个特征返回时间(Characteristic return time)TR将十分方便:TR=1/r,即内禀增长率越大,特征返回时间越短。显然,种群平衡位置取决于K,而种群动态则取决于r(May 1976)。
这样容易想象,较大的r(较短的TR)将有利于种群从不利的时期较快的恢复,是对非稳定性环境的一种适应,但却增大种群随环境的波动性;相反,较小的r意味着较长的反应时间及较好的种群稳定性,是对稳定的生境容纳量的一种适应,其缺点是种群对损伤性干扰的恢复较慢(May 1976)。因此,r—对策者也被认为是一种开拓者(exploiter)或机会主义者(opportunist)。
r实际上取决于净生殖率R0和世代时间Tc:
r ≈ (lnR0)/Tc (2.1)
从方程式(2.1)可以看出,r对世代时间的改变比对R0的改变更为敏感,譬如世代时间减半,r值就加倍;但是加倍R0,r将只以自然对数值之差而增加,如当R0从5增加到10,r将从1.6增加到2.3(May 1976)。
需要指出的是,这里所说的r对策者嗜好暂时性生境和K对策者嗜好稳定性生境都是相对的和理想的,实际上,在很多情况下,r和K对策者都共存于同一种生境中,但它们可能占据了不同的生态位置,这也就是所谓的“生态位”的概念。打个比喻,生境就像一栋大楼,楼内的房间就像生态位。此外,生态系统既有各种各样的生产者,还有各种各样的消费者及分解者,同一个生境也需要各式各样的生物行使不同的生态功能。
八、结语
如果不懂得生命的设计(当然,是通过适应、变异与“自然”选择等)原理,如何来认知地球上数百万种大大小小、形形色色的生物物种的生存与演化?幸运的是,大自然沿着生命的尺度宏观且相当精准地设计了个体的基本生物学特征(世代时间、生长速率、摄食率、代谢速率)和生态学特征(运动速度、内禀增长率、群密度种、活动范围、物种多样性)。这种生命的范式是生命不断地适应环境与被环境自然选择的结果,因此是生命历史演化的产物。
生命总体的演进方向是体型与遗传信息趋于多样化与复杂化,一些类群趋于大型化,当然这一过程还受到外部环境(非生物的气候条件与生物的种间关系)的塑造,因此,生命的特性也是在生存条件约束下方向性演化的产物。生命尺度决定了物种的生态对策(r和K对策)—既关系到人类对物种的管理,也关系到物种的历史演化。此外,生命的尺度还决定了物种的生殖对策。
参考:从生态学透视生命系统的设计、运作与演化—生态、遗传和进化通过生殖的融合(谢平著,科学出版社,2013)
上一篇:人工生命: 从原核到真核
